导读:EGFR-TKI开启了肺癌靶向治疗的新时代,作为三代EGFR-TKI奥希替尼不仅解决1代、2代药物最主要T790M耐药问题(二线治疗),而且获批一线治疗和术后新辅助治疗,成为超级重磅炸弹,也因此成为众多药企“必争之地”。
耐药是小分子抑制剂难逃的魔咒,奥西替尼一线治疗后耐药患者的治疗探索,已经有不少积极的结果。本文主要介绍国内三代EGFR-TKI的研发现状以及三代耐药后的探索。
一、肺癌及EGFR-TKI治疗
肺癌(Lung Cancer)是发病率和死亡率居首位的癌种,严重威胁着人类的健康与生命。肺癌主要分为小细胞肺癌(SCLC)和非小细胞肺癌(NSCLC),其中约80%为NSCLC。早期的NSCLC主要依靠手术治疗,但多数NSCLC患者初诊时已是中晚期,只能以化疗药物治疗为主,mPFS约为6-7个月。2003年第一代小分子EGFR激酶抑制剂(EGFR-TKI)吉非替尼的上市,开启了肺癌靶向治疗的新时代,大幅延长mPFS至10.9个月,从而把非小细胞肺癌的治疗推向了“个体化”的方式,效果更好且副作用更小的靶向药物正在逐渐取代传统化疗药物成为一线药物。
EGFR(表皮生长因子受体)是一种位于细胞膜上的酪氨酸激酶受体。EGFR是表皮生长因子受体(HER)家族成员之一。该家族包括EGFR(也称HER1)、HER2、HER3及HER4。在正常情况下,当与配体 EGF(表皮生长因子)结合,就会被激活,开启下游两种信号通路:参与细胞增殖的RAS-RAF-MEK-ERK,以及参与细胞存活的PI3K-AKT-mTOR途径。不管是增殖、还是存活,都对于细胞格外重要,因此EGFR的活性正常情况下要被严格调控,其激活常常是短暂的。当EGFR基因发生某些突变时,即使没有与配体(EGF)结合,依然可以持续活化和激活下游信号通路,从而导致细胞持续增殖和生存,诱发癌症。
亚洲NSCLC患者中,有30%-40%是EGFR突变,但幸运的是,当被诊断为EGFR突变时,绝大多数(90%+)是以下两种:L858R(21号外显子L858R基因突变)和Del19(19号外显子缺失),从而导致活性无法被正常关闭。之所以说幸运,因为EGFR的恶性突变有几十种,而这两种已经被研发出了特异性的抑制剂EGFR-TKI,它通过抑制 EGFR 酪氨酸激酶活性阻断其下游信号通路激活,而且,因为可以口服、副作用小(相比于化疗)、疗效显著等优点,迅速成为爆款药物,开启了靶向治疗的新时代。
已上市的EGFR抑制剂有三代,第一代EGFR-TKIs是EGFR可逆抑制剂,代表药物有吉非替尼、厄洛替尼、埃克替尼,第二代EGFR-TKIs是不可逆泛HER抑制剂,代表药物有阿法替尼、达克替尼。第二代EGFR-TKIs开发的初衷是为了解决T790M耐药问题,然而结果却不尽如人意。虽然在疗效上相比第一代有提高,但提升不明显;加上副作用也更严重,因此临床上应用并不是非常广泛。第一、二代靶向药物虽然疗效显著,但2/3的患者都会在使用药物1-2年出现耐药性,其中绝大部分都是因为肿瘤细胞很“狡猾”的让EGFR基因产生了新的突变,T790M,在790位氨基酸由苏氨酸变为蛋氨酸,从而使第一、第二代小分子抑制剂失效。于是,第三代EGFR-TKI问世,抑制 T790M 这个突变,同时在抑制EGFR 活化突变上取得了惊人的疗效,代表药物奥希替尼的肿瘤控制率达到90%,甚至可以惠及脑转移患者。
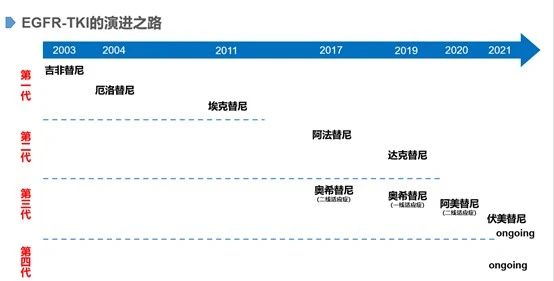
二、三代EGFR-TKI:奥希替尼成为重磅炸弹,国内竞争激烈
奥希替尼是一种口服的小分子第三代EGFR-TKI,是首个针对EGFR T790M突变的肺癌药物。三代EGFR抑制剂泰瑞沙(奥希替尼)2020年全球销售收入达43.28亿美元,同比增长36%,毫无疑问的重磅炸弹。
随着第二款国产三代EGFR-TKI伏美替尼(旧称艾氟替尼)获批上市,目前国内已有三款三代EGFR-TKI上市,是全球最多三代EGFR-TKI上市的市场。
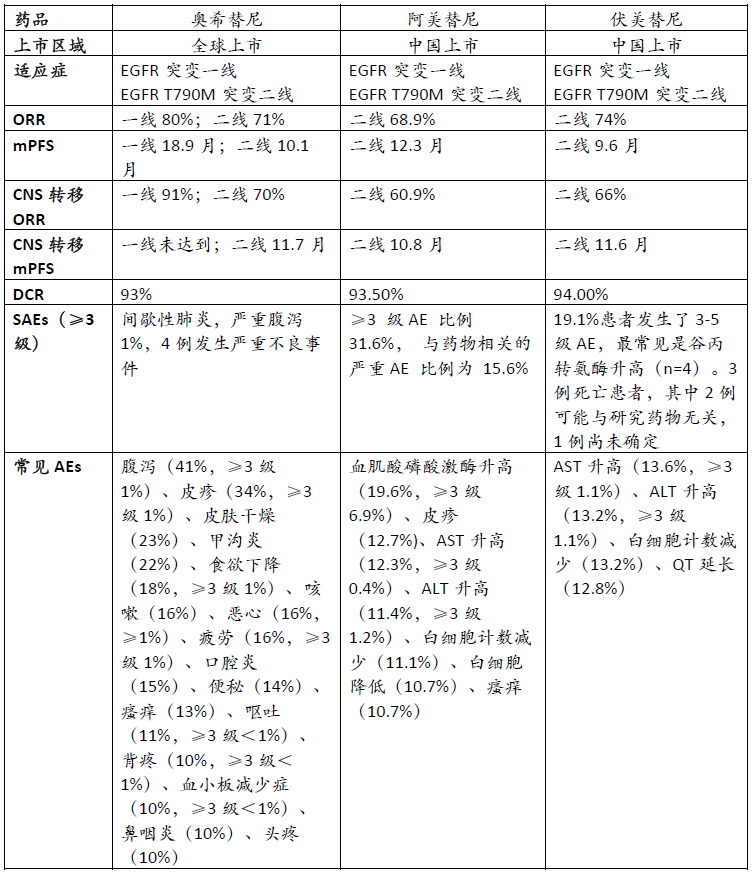
目前阿美替尼、伏美替尼公布的是二线治疗的数据,研究处于I\II期阶段,尚未有大型的III期临床研究,所以上市状态都是附条件上市,后续还需要补充III期临床研究数据。从现有早期临床数据看阿美替尼、伏美替尼与奥希替尼有效性差异不大。安全性方面表现差异较大,奥希替尼主要副作用为腹泻和皮疹,阿美替尼和伏美替尼均有较高比例出现ALT、AST升高,提示可能有一定肝毒性。
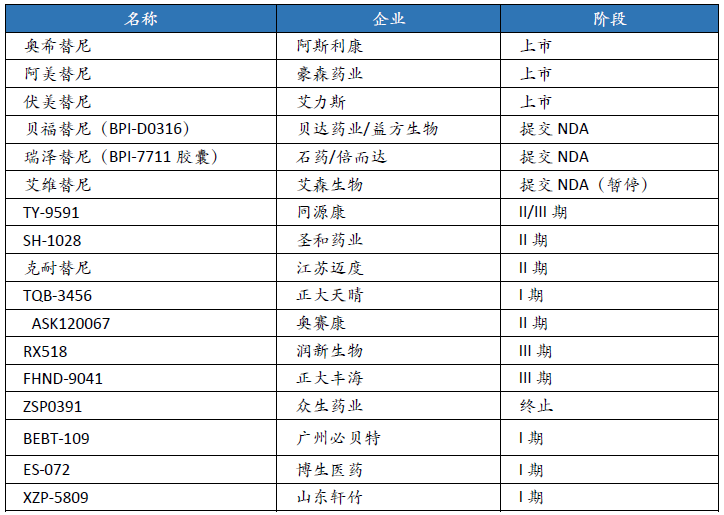
目前国内多家厂商依然在积极进行三代EGFR-TKI临床研发:
三、三代EGFR-TKI抑制剂市场及格局
FLAURA和AURA3临床研究奠定了奥希替尼在肺癌EGFR敏感突变治疗中一线和二线地位;ADAURA研究(针对有EGFR突变的ⅠB/Ⅱ/ⅢA期非小细胞肺癌,术后使用奥希替尼进行辅助治疗)结果惊艳,并于2020年12月获批用于肺癌术后辅助治疗,未来市场将进一步打开。如此诱人的大蛋糕也难怪“引无数英雄竞折腰”。目前国内自主研发的三代EGFR抑制剂大都是针对EGFR敏感突变(L858R和Del19)及T790M耐药突变,属于me-too类产品,奥希替尼优异的有效性和安全性数据将研发门槛抬得非常高,真正可以突破奥希替尼的产品少之又少,出现me-worse类产品也并不让人惊讶。
值得一提的是,国内小分子创新药研发企业同源康的拳头产品氘代奥希替尼,通过引入氘,具有更强的稳定性和更好药代动力学表现,有望实现不输奥希替尼的临床效果,目前该品种即将开展和奥希替尼肺癌EGFR突变一线头对头临床3期临床试验。
国内三代EGFR-TKI临床研发赛道拥挤,无论是在用药选择还是价格,对于国内病患都是利好的。但对于药企来说,尤其在中国集采和“ 以临床价值为导向的抗肿瘤药物临床研发指导原则”的政策背景下,是需要审慎考量产品的临床价值和竞争优势。好在,EGFR在整个癌症领域都占据着极为重要的地位,奥希替尼在新辅助疗法惊艳的数据以及对T790M阴性患者人群的积极结果,预示着三代EGFR-TKI的市场空间还有进一步打开的空间。优秀的产品力和差异化临床策略将有助于企业分到一杯羹。
四、三代EGFR-TKI耐药机制
三代EGFR-TKI 耐药机制主要有三种情况:
在靶耐药机制:EGFR 基因在T790M后发生了再次突变,比如C797S 突变,引起 EGFR 激酶区结构改变,从而影响它与 EGFR-TKI 的结合,最终导致耐药(EGFR依赖性耐药);
靶外耐药机制:下游信号通路异常(如KRAS、BRAF V600E突变)或旁路激活(如MET、HER2、HER3、RET、ROS1 等基因突变);
其他机制:包括小细胞转化,上皮-间充质转化(EMT)等。
对于第一代和第二代 TKI,最常见的耐药机制是发生 EGFR T790M 突变。奥希替尼一线应用和在 T790M 出现后的后线应用,二者耐药机制并不完全相同。三代 TKI 一线应用时,EGFR 依赖性耐药途径发生率比较低,其中最常见的是 C797S 三次耐药突变,只占全部耐药机制的 7%。而 EGFR 非依赖途径也即旁路活化比较常见,其中最常见的是 MET 扩增,占到 15%,另外还有RET 融合、BRAF 融合,组织学转化等。

五、三代EGFR-TKI耐药后的治疗之路
目前三代EGFR-TKI 耐药的治疗思路是针对不同耐药机制精准治疗,也是最容易想到的思路。例如,针对C797S 突变、MET 扩增、Her2扩增、RET融合等常见耐药突变开发针对性精准治疗的药物,目前已经取得了非常不错的结果。这种思路的缺陷在于“小众突变”不被重视和对机制不明耐药束手无策。三代EGFR-TKI一线治疗后的耐药机制更加复杂和多元,且接近一半的耐药机制不明。C797S突变(仅7%,对比1/2代EGFR-TKI耐药中T790M超过50%)、MET扩增(15%)及RET融合(在肿瘤初始分型中本身有一定比例,约1-2%)等适应症人群相对较多的突变,是目前研发的热点。毕竟更加细分的人群,意味着更加细分的市场空间。在海外市场,快速审评制度、商保及更强的支付能力情况下,国内企业想要再这一路径下有所突破需要走国际化道路。
另外一种思路是“差异化药物作用机理”,以期实现覆盖多种耐药突变并对机制不明耐药有一定效果。例如最近非常火热的ADC药物(抗体药物偶联物),ADC的独特作用机制,通过内吞后释放毒素直接杀伤癌细胞,理论上对很多耐药突变同样有效。目前双抗、ADC等治疗手段已经取得了非常亮眼的数据。相对而言,这种思路能够覆盖多种耐药突变,尤其是机制不明的耐药,是一条更加值得探索的道路。
目前三代EGFR-TKI耐药后的药物研发进展梳理:
1. C797S
单纯 C797S 突变,无 T790M 突变,单用 EGFR-TKI 治疗有效;存在 C797S 和 T790M 反式突变(两种突变在不同 DNA 链上),三代+一代EGFR-TKI 治疗有效。目前治疗的难点是C797S 和T790M 顺式突变(两种突变在同一条 DNA 链上),占85%。
1)联合用药
针对 C797S/T790M 顺式突变目前治疗策略主要集中在联合治疗方面。
布加替尼(ALK抑制剂)+西妥昔单抗(EGFR IgG1单抗)治疗 EGFR 19del 或 L858R/T790M/C797S 顺式突变(n = 15)取得了不错的疗效,客观缓解率(ORR)为 60%,疾病控制率(DCR)为100%,中位 PFS 达 14 个月。
奥希替尼+耐昔妥珠单抗(EGFR IgG1单抗)治疗奥希替尼耐药后的 C797S/T790M 患者,显示出了初步的疗效,ORR 为 50%(2/4)。
2)第四代EGFR-TKI
a)BLU945
BLU945 是 BlueprintMedicines 公司研发的专门针对于奥希替尼耐药后继发的 T790M/C797S 共发突变及其他 T90M 耐药突变的四代 EGFR-TKI 药物。在 EGFR 经典突变+/T790M/C797S 突变的 PDX 模型中,BLU-945 单药及联合奥希替尼均显示出较强的抗肿瘤活性。
b)TQB3804
TQB3804 是由我国正大天晴研发的第四代口服EGFR 靶向药。TQB3804在19del/T790M/C797S的不同模型中,都能较好地延缓肿瘤的增长,而奥希替尼却无法阻止C797S肿瘤的生长。TQB3804不仅能克服3代TKI耐药后产生的两大类常见三重突变(19del/T790M/C797S,L858R/T790M/C797S),更能抑制EGFR野生突变和前二代靶向药物引发的T790M突变。
2. Met扩增
MET-TKI 联合 EGFR-TKI 对 EGFR-TKI 耐药伴 MET 扩增的患者是一种有希望的治疗策略,在许多临床研究中有所探讨。目前比较值得关注的特异性 MET-TKI 包括赛沃替尼(Savolitinib)、Capmatinib、Tepotinib。
1)赛沃替尼(Savolitinib)
赛沃替尼(Savolitinib)是和记黄埔医药开发的可选择性MET抑制剂,2021年6月22日NMPA获批上市,是我国首个获批的特异性靶向MET激酶的小分子抑制剂。赛沃替尼联合奥希替尼治疗一/二代 EGFR-TKI 进展,T790 阴性,MET 扩增的患者,ORR 达 64%,PFS 达 9.1 个月。对于三代EGFR-TKI 进展,MET 扩增的患者,ORR 达 30%,PFS 达 5.4 个月。此外,在生物标志物的选择方面,研究结果显示 MET 扩增程度越高,MET 抑制剂疗效越好。
2)Tepotinib
Tepotinib是全球首个获批上市的口服MET抑制剂。目前已经启动Tepotinib+奥希替尼用于奥希替尼一线治疗后MET扩增导致耐药患者的INSIGHT 2的临床。
3. Her2扩增
早期临床研究探索了针对 HER2异常靶点的 TKI 药物,比如波奇替尼、达克替尼等,然而疗效并不理想。针对 HER2 的 ADC 类药物后来居上(T-DM1和DS-8201),令人眼前一亮。
1)T-DM1
T-DM1,是曲妥珠单抗-美坦新的偶联物,T-DM1 在一项小型研究中(入组 HER2 突变肺腺癌患者 15 例),ORR 44%,PFS 5个月。II期TRAEMOS研究期中分析,T-DM1剂量为3.6mg/kg,在可评估疗效的24例患者中,12周后ORR和DCR分别为13%和43%;在HER2 IHC2+和3+人群中,DCR分别为36%(5/14)和55%(5/9)。
2)DS-8201
DS-8201,由靶向 HER2 的抗体和拓扑异构酶Ⅰ抑制剂偶联而成。在 DESTINY-Lung01 研究中,入组 42 例患者,DS-8201 治疗的ORR 达 61.9%,DCR 达 90.5%,PFS 达 14.0 个月。因此,DS-8201 在未来很可能成为 HER2 突变 NSCLC 治疗中非常重要的一款药物。
4. RET 融合
RET 基因改变主要分为 RET 突变和 RET 融合。针对 RET 靶向药物的研发从多靶点药物一直发展到特异性 RET 抑制剂。早期针对 RET 改变的 NSCLC 抑制剂为多靶点抑制剂(比如凡德他尼、卡博替尼、伦伐替尼),临床研究结果疗效不甚理想,且毒性较大。近年 RET 特异性抑制剂取得了很大突破。
1)LOXO-292(Selpercatinib)
LIBRETTO-001 研究中,入组 105 例经治 RET 融合 NSCLC 中,其中32.4% 患者既往接受多靶点抑制剂治疗,LOXO-292(Selpercatinib)取得了 ORR 64%,PFS 16.5 个月,CNS ORR 91% 的疗效,FDA 很快批准了 LOXO-292 用于 RET 基因改变的治疗(2020年5月8日)。
2)普拉替尼(BLU-667)
ARROW 研究中,入组 132 例 RET 融合 NSCLC,78% 既往接受化疗或免疫治疗,普拉替尼(BLU-667)取得了 ORR 58%,DCR88%,CNS ORR 56% 的疗效,同样获得了 FDA 的批准(2020年9月5日)。
5. 抗体类
EGFR-TKIs靶向于EGFR受体的胞内结构域,而EGFR抗体则结合EGFR受体的胞外结构域阻断该信号通路,理论上可以克服多种耐药突变。EGFR单抗通常与化疗联用。目前大部分临床研究表明,EGFR单抗联合化疗是安全的,但生存获益不明显。例如在二线及以上治疗中,西妥昔单抗+化疗并未改善生存,且明显增加AEs。
新型抗体药物形式的出现,包括双抗与ADC,为EGFR靶向药物研发提供了新的思路。
1)JNJ-372(Amivantamab)-双抗
针对 EGFR/c-MET 的双抗体 JNJ-372(Amivantamab),无论单药或者联合 Lazertinib 应用于 EGFR-TKI 耐药的患者,均显示出较好的疗效。Amivantamab联合lazertinib治疗EGFR突变晚期NSCLC的研究数据显示,在45例奥希替尼耐药且未接受过化疗的患者队列中,客观缓解率(ORR)为36%,1例完全缓解(CR),15例患者部分缓解(PR)。中位随访8.2个月。
JNJ-372 针对的靶点较多,有望称为EGFR 耐药处理的一种新的治疗思路和治疗选择。
2)U3-1402-ADC
U3-1402是日本第一三共制药研发的HER3抗体偶联体药物,由HER3 单抗Patritumab 通过四肽连接子与拓扑异构酶I 抑制剂Deruxtecan (Dxd)偶联而成。 它同样对多个 EGFR-TKI 耐药靶点显示出有效性,不仅针对靶内的耐药有效,对靶外耐药同样有效。
ASCO2021更新的I期研究数据,57例既往接受过EGFR-TKI治疗的EGFR突变的局晚期或者晚期NSCLC患者,中位治疗线数为4,其中86%的患者既往接受过奥希替尼治疗。所有的患者接受patritumab deruxtecan 5.6 mg/kg IV Q3W 治疗,中位随访10.2 个月,中位治疗持续时间为5.5个月,其中有32%的患者仍在治疗中。客观缓解率(ORR)为39%(1 例CR, 21 例PR),疾病控制率(DCR)为 72%,中位缓解持续时间(mDoR)为 6.9 个月 ,中位 PFS 为8.2 个月。在EGFR C797S突变、MET基因扩增、HER2突变和BRAF融合患者中均观察到肿瘤部分缓解。
3)MRG003-ADC
针对EGFR靶点的ADC国内有乐普生物(MRG003)、昭华生物、恒瑞医药(SHR-A1307)、荣昌生物(RC68)等多家生物技术公司布局,目前仅乐普生物MRG003进入临床研究阶段。
MRG003是乐普生物旗下美雅柯开发的、由EGFR靶向单抗与强效的微管抑制剂MMAE分子通过vc链接体偶联而成的ADC,是创新性靶向EGFR的ADC类药物。今年ESMO大会,由中山大学肿瘤防治中心徐瑞华教授领衔的探索MRG003的I期临床研究同时入选ESMOePoster。该研究27例进行疗效评估的Ib患者(27/39)中,最佳客观反应(BOR)包括11例部分缓解(PR,8例确认)和9例疾病稳定(SD),ORR为30%,DCR为63%。其中SCCHN患者的ORR为40%,DCR为80%,NPC患者的ORR为44%,DCR为78%。
目前公布的数据没有晚期NSCLC数据,但根据乐普生物招股书,公司已经在开展MRG003针对晚期NSCLC的II期研究,效果如何,一起拭目以待。
六、结语
国内三代EGFR-TKI临床研发赛道拥挤,对于药企来说,尤其在中国集采和“以临床价值为导向的抗肿瘤药物临床研发指导原则”的政策背景下,是需要审慎考量产品的临床价值和竞争优势。好在市场空间巨大,优秀的产品力和差异化临床策略将有助于企业分到一杯羹。
目前三代EGFR-TKI 耐药的治疗思路是针对不同耐药机制精准治疗,并有积极的结果。这种思路的缺陷在于“小众突变”不被重视和对机制不明耐药束手无策。另外一种思路是“差异化药物作用机理”,以期实现覆盖多种耐药突变并对机制不明耐药有一定效果,在双抗、ADC等方面已经取得了非常亮眼的数据。相对而言,第二种思路能够覆盖多种耐药突变,尤其是机制不明的耐药,是一条更加值得探索的道路。
本文仅供研究交流,不代表任何投资判断和观点
关于阳光融汇资本
阳光融汇资本成立于2015年1月,是中国保险业首批由保险资金发起设立的私募基金管理公司,基金管理规模达300亿元,专注投资于医疗健康、新兴科技领域,投资包括迈瑞医疗、新瑞鹏集团、英盛生物、乐普生物、圣诺制药、泰诺麦博、硅基仿生、启辰生、赛德阳光、朝聚眼科、宽腾医疗、华芯医疗、商汤科技、满帮、青云科技、燧原科技、英韧科技、齐碳科技、创新奇智、摩尔线程、梦之墨等明星企业。
- 原文地址
- /web/information_news_detail.php?id=102
- 复制链接
